FastKing One Step RT-PCR Kit
Đặc trưng
■ Độ tinh khiết: Phản ứng sao chép ngược và phản ứng PCR được hoàn thành trong một bước để tránh nhiễm bẩn chéo.
■ Hiệu quả cao: Men sao chép ngược King duy nhất với hiệu suất RT trên 95%.
■ Nhạy cảm: Có thể xác định chính xác khoảng 1 ng mẫu, đặc biệt đối với các mẫu có độ phong phú thấp.
■ Tính đặc hiệu: Taq polymerase được biến tính bằng kháng thể cải thiện hơn nữa hiệu quả khuếch đại và độ đặc hiệu.
Các ứng dụng
Nó thích hợp để phát hiện mức độ biểu hiện gen trong tế bào và mô, nhân bản cDNA của các gen cụ thể và phát hiện virus RNA. Nó đặc biệt thích hợp để phát hiện định tính các mẫu có độ phong phú thấp.
Tất cả các sản phẩm có thể được tùy chỉnh cho ODM / OEM. Để biết chi tiết,vui lòng nhấp vào Dịch vụ tùy chỉnh (ODM / OEM)
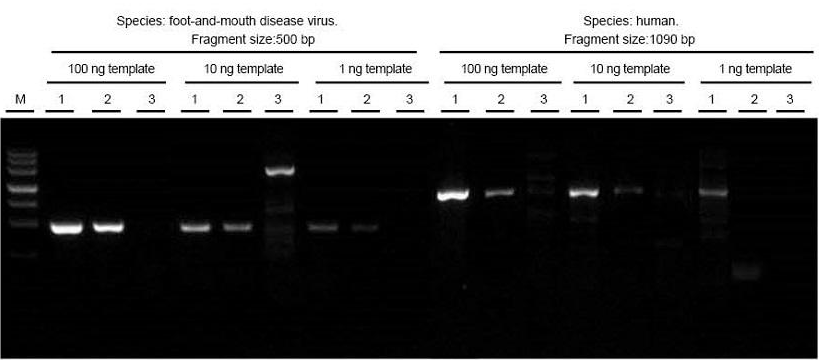 |
RNA tổng số của vi rút bệnh lở mồm long móng và các mẫu mô người được chiết xuất tương ứng. Đảo ngược bản sao và PCR các đoạn mục tiêu có độ dài khác nhau bằng cách sử dụng TIANGEN FastKing One Step RT-PCR Kit (1), các sản phẩm liên quan từ Nhà cung cấp A (2) và Nhà cung cấp B (3) và quan sát các sản phẩm PCR sau khi điện di. Kết quả cho thấy dải của FastKing One Step RT-PCR Kit rõ ràng và sáng sủa, không có đuôi và không có dải không cụ thể, đồng thời có thể phát hiện rõ 1 ng mẫu. Kết quả thử nghiệm của TIANGEN tốt hơn so với kết quả của các sản phẩm có liên quan. |
ARN A-1 bị thoái hóa
——Làm sạch RNA chất lượng cao mà không bị nhiễm bẩn. Nguyên liệu mà từ đó RNA được chiết xuất phải càng tươi càng tốt để ngăn chặn sự phân hủy RNA. Phân tích tính toàn vẹn RNA trên gel biến tính trước phản ứng RT. Sau khi chiết xuất RNA, nó nên được bảo quản trong 100% formamide. Nếu sử dụng chất ức chế RNase, nhiệt độ gia nhiệt phải <45 ° C và pH phải nhỏ hơn 8,0, nếu không chất ức chế sẽ giải phóng tất cả RNase liên kết. Hơn nữa, chất ức chế RNase nên được thêm vào các dung dịch có chứa ≥ 0,8 mM DTT.
ARN A-2 chứa các chất ức chế phản ứng phiên mã ngược
—— Các chất ức chế phiên mã ngược bao gồm SDS, EDTA, glycerol, natri pyrophosphat, essenceidine, formamide, muối guanidine, v.v. Trộn RNA đối chứng với mẫu và so sánh sản lượng với phản ứng RNA đối chứng để kiểm tra xem có chất ức chế hay không. Rửa kết tủa RNA bằng ethanol 70% (v / v) để loại bỏ chất ức chế.
A-3 Ủ không đủ mồi được sử dụng để tổng hợp chuỗi cDNA đầu tiên
——Xác định rằng nhiệt độ ủ phù hợp với các loại mồi được sử dụng trong thí nghiệm. Đối với hexamers ngẫu nhiên, nên giữ nhiệt độ ở 25 ° C trong 10 phút trước khi đạt đến nhiệt độ phản ứng. Đối với mồi dành riêng cho gen (GSP), hãy thử GSP khác hoặc chuyển sang oligo (dT) hoặc hexamer ngẫu nhiên.
A-4 Một lượng nhỏ RNA khởi đầu
——Tăng lượng RNA. Đối với các mẫu RNA nhỏ hơn 50 ng, 0,1 μg đến 0,5 μg acetyl BSA có thể được sử dụng trong quá trình tổng hợp cDNA sợi đầu tiên
A-5 Trình tự đích không được biểu hiện trong các mô được phân tích.
——Hãy thử các loại khăn giấy khác.
Phản ứng PCR A-6 không thành công
——Đối với RT-PCR hai bước, mẫu cDNA trong bước PCR không được vượt quá 1/5 thể tích phản ứng.
A-1 Ủ không cụ thể của sơn lót và khuôn mẫu
——Đầu 3'của mồi không được chứa 2-3 dG hoặc dC. Sử dụng mồi đặc hiệu cho gen trong tổng hợp sợi đầu tiên thay cho mồi ngẫu nhiên hoặc oligo (dT). Sử dụng nhiệt độ ủ cao hơn trong vài chu kỳ đầu tiên, và sau đó là nhiệt độ ủ thấp hơn. Sử dụng Taq DNA polymerase khởi động nóng cho PCR để cải thiện độ đặc hiệu của phản ứng.
A-2 Thiết kế kém các đoạn mồi dành riêng cho gen
—— Tuân theo các nguyên tắc tương tự để thiết kế mồi khuếch đại.
ARN A-3 bị ô nhiễm với ADN bộ gen
——Xử lý RNA bằng PCR-grade DNase I. Thiết lập phản ứng kiểm soát mà không cần phiên mã ngược để phát hiện sự ô nhiễm DNA.
A-4 Hình thành sơn lót
——Thiết kế các đoạn mồi không có trình tự bổ sung ở đầu 3 '.
A-5 Mg quá cao2+ nồng độ
——Tối ưu hóa Mg2+ nồng độ cho mỗi mẫu và tổ hợp mồi
A-6 Bị nhiễm DNA ngoại lai
——Sử dụng các mẹo chống khí dung và các enzym UDG.
A-1 Hàm lượng của sản phẩm sợi đầu tiên quá cao
——Giảm lượng sản phẩm sợi đầu tiên trong bước phản ứng PCR thông thường.
A-2 Lượng mồi quá cao trong phản ứng PCR
——Giảm lượng mồi đầu vào.
A-3 Quá nhiều chu kỳ
——Tối ưu hóa các điều kiện phản ứng PCR và giảm số chu kỳ PCR.
A-4 Nhiệt độ ủ quá thấp
——Tăng nhiệt độ ủ để ngăn hiện tượng bắt đầu và kéo dài không cụ thể.
A-5 Khuếch đại không đặc hiệu của các đoạn oligonucleotide được tạo ra bởi sự phân hủy DNase của DNA —— Tách RNA chất lượng cao để ngăn chặn sự ô nhiễm DNA.
RT-PCR là để phiên mã ngược RNA thành cDNA, và sau đó sử dụng cDNA phiên mã ngược làm khuôn mẫu cho phản ứng PCR để khuếch đại đoạn đích. Chọn các cặp mồi ngẫu nhiên, Oligo dT và cặp mồi đặc hiệu của gen tùy theo điều kiện cụ thể của thí nghiệm. Tất cả các đoạn mồi trên đều có thể được sử dụng cho mARN của tế bào nhân thực ngắn không có cấu trúc kẹp tóc.
Mồi ngẫu nhiên: Thích hợp cho RNA dài có cấu trúc kẹp tóc, cũng như tất cả các loại RNA như rRNA, mRNA, tRNA, vv Chúng chủ yếu được sử dụng cho phản ứng RT-PCR của khuôn mẫu đơn.
Oligo dT: Thích hợp với RNA có đuôi PolyA (RNA nhân sơ, rRNA Oligo dT sinh vật nhân chuẩn và tRNA không có đuôi PolyA). Bởi vì Oligo dT được liên kết với đuôi PolyA, chất lượng của mẫu RNA được yêu cầu cao, và ngay cả một lượng nhỏ sự phân hủy cũng sẽ làm giảm đáng kể lượng tổng hợp cDNA có chiều dài đầy đủ.
Đoạn mồi đặc hiệu cho gen: Bổ sung cho trình tự khuôn mẫu, thích hợp cho các trường hợp đã biết trình tự đích.
Có hai cách:
1. Phương pháp đối chiếu bên trong: Về lý thuyết, cDNA là các đoạn DNA có độ dài khác nhau nên kết quả điện di là phết tế bào. Nếu lượng RNA thấp, không có sản phẩm nào hiển thị trong điện di, nhưng điều này không có nghĩa là không có sản phẩm nào sẽ được khuếch đại bằng PCR. Nói chung, tham chiếu nội bộ có thể được sử dụng để phát hiện cDNA. Nếu tham chiếu nội bộ có kết quả, chất lượng của cDNA về cơ bản có thể được đảm bảo (trong một số trường hợp, nếu đoạn gen đích quá dài, có thể có ngoại lệ).
2. Nếu có một gen đã biết được khuếch đại bởi khuôn mẫu này, nó có thể được xác minh bằng các đoạn mồi của gen này. Việc khuếch đại tham chiếu bên trong không nhất thiết có nghĩa là không có vấn đề gì với cDNA. Bởi vì tham chiếu bên trong có độ phong phú cao trong cDNA, nó dễ dàng khuếch đại. Nếu cDNA bị phân hủy một phần vì nhiều lý do khác nhau, từ góc độ xác suất, kết quả PCR của các gen mục tiêu có độ phong phú thấp sẽ bị ảnh hưởng rất nhiều. Trong khi tham chiếu bên trong vẫn còn nhiều, khả năng khuếch đại sẽ không bị ảnh hưởng.
Phân hủy một phần RNA. Phát hiện tính toàn vẹn và tinh sạch của RNA
Hàm lượng RNA của các loài khác nhau có thể khác nhau, nhưng nói chung, RNA tổng số được chiết xuất phải chứa hai dải 28S và 18S rõ ràng trong điện di trên gel, và độ sáng của dải trước phải cao gấp đôi so với dải sau. Dải 5S chỉ ra rằng RNA đã bị suy thoái và độ sáng của nó tỷ lệ thuận với mức độ suy thoái. Việc khuếch đại thành công tham chiếu bên trong không có nghĩa là không có vấn đề gì với ARN, bởi vì tham chiếu bên trong có độ phong phú cao, ARN có thể được khuếch đại miễn là sự suy thoái không nghiêm trọng. OD260/ OD280Tỷ lệ RNA tinh khiết được đo bằng máy quang phổ phải từ 1,9 đến 2,1. Một lượng nhỏ tạp chất protein trong RNA sẽ làm giảm tỷ lệ. Miễn là giá trị không quá thấp, RT sẽ không bị ảnh hưởng. Điều quan trọng nhất đối với RT là tính toàn vẹn của RNA.
Việc mở rộng gen tham chiếu bên trong chỉ có thể chỉ ra rằng RT đã thành công, nhưng nó không nhất thiết liên quan đến chất lượng của sợi cDNA. Bởi vì các đoạn tham chiếu bên trong thường có kích thước nhỏ và biểu hiện cao, chúng dễ dàng thành công hơn trong quá trình phiên mã ngược. Tuy nhiên, kích thước và sự biểu hiện của gen mục tiêu khác nhau giữa các gen. Chất lượng cDNA không thể được đánh giá chỉ bằng tham chiếu bên trong, đặc biệt là đối với các đoạn đích dài hơn 2 kb.
Một số mẫu có cấu trúc thứ cấp phức tạp, hoặc có hàm lượng GC phong phú, hoặc quý với độ phong phú thấp. Trong những trường hợp này, nên chọn loại men sao chép ngược thích hợp tùy theo kích thước của đoạn đích và mẫu. Đối với các khuôn mẫu RNA có hàm lượng GC cao và cấu trúc bậc hai phức tạp, rất khó để mở cấu trúc bậc hai ở nhiệt độ thấp, hoặc với enzym phiên mã ngược thông thường. Đối với các khuôn mẫu này, có thể chọn Quant Reverse Transcriptase, vì hiệu suất phiên mã ngược của nó rõ ràng là tốt hơn so với enzym phiên mã ngược dòng M-MLV, có thể phiên mã ngược các mẫu RNA khác nhau một cách hiệu quả và phiên mã RNA thành sợi đầu tiên cDNA ở mức tối đa. Khi sử dụng kit phiên mã ngược chung, hệ thống 20 μl chỉ có thể phiên mã ngược hiệu quả 1 μg RNA tổng số. Hãy chú ý đến công suất RT tối đa của kit. Nếu bổ sung quá mức khuôn mẫu, quá trình phiên mã ngược sẽ tạo điều kiện thuận lợi cho RNA có độ phong phú cao. Vì vậy, tốt hơn hết là không vượt quá công suất tối đa của hệ thống.
A-1 Xác định xem RNA có bị phân hủy nghiêm trọng hay không và liệu RT có thành công hay không
Nói chung, lý do cho sự thất bại của quá trình khuếch đại tham chiếu bên trong thường là do sự suy thoái RNA nghiêm trọng. Một lý do có thể khác là sự thất bại trong quá trình phiên mã ngược. Tham chiếu bên trong không thể được sử dụng làm tiêu chuẩn để đánh giá chất lượng của sợi đơn cDNA, nhưng nó có thể được sử dụng làm tiêu chuẩn để đánh giá liệu phiên mã ngược có thành công hay không nếu không có vấn đề về chất lượng RNA. Điều quan trọng nhất của quá trình phiên mã ngược là phải duy trì nhiệt độ ổn định và hệ phản ứng không đổi nhằm nâng cao hiệu suất phản ứng.
A-2 Xác định liệu các đoạn mồi để khuếch đại gen tham chiếu bên trong có đáng tin cậy hay không và liệu có vấn đề gì với thuốc thử được sử dụng trong PCR hay không.
Để định lượng tương đối, RNA phải được định lượng trước khi phiên mã ngược, điều này cũng được yêu cầu trong nhiều bộ phiên mã ngược, ví dụ, định lượng RNA đầu vào là 1 μg. Vì cDNA được phiên mã ngược là một dung dịch hỗn hợp, bao gồm RNA, oligo dT, enzyme, dNTP và thậm chí một ít DNA còn sót lại nên sẽ gây ra sai lệch, do đó không thể định lượng chính xác cDNA. Do đó, việc định lượng RNA là cần thiết. Xét hiệu suất phiên mã ngược là như nhau giữa các mẫu khác nhau, lượng cDNA thu được phải giống nhau và phân tích định lượng có thể cho thấy sự so sánh mức độ biểu hiện của các gen khác nhau trong cùng một lượng RNA tổng số. Khi thực hiện PCR định lượng huỳnh quang tương đối, cDNA định lượng có thể không được yêu cầu sau khi phiên mã ngược vì gen tham chiếu bên trong có thể hoạt động như tham chiếu.
Nó chủ yếu liên quan đến các gen, và phiên mã ngược của đoạn dài là không khả thi đối với hầu hết các gen. Thứ nhất, hiệu quả của phiên mã ngược thấp hơn nhiều so với PCR. Thứ hai, vùng giàu GC và cấu trúc bậc hai của nhiều gen hạn chế cả phiên mã ngược và PCR. Cuối cùng, độ trung thực và hiệu quả khuếch đại của PCR khó được đảm bảo cùng một lúc. Trong quá trình phiên mã ngược, không ai có thể đảm bảo nhận được đoạn dài cho gen sao chép thấp, đặc biệt là sử dụng oligo dT. Còn UTR 5 'với nhiều GC hơn thì càng khó hơn. Do đó, vẫn là một phương pháp hợp lý để sao chép ngược với các đoạn mồi ngẫu nhiên, tìm các vị trí phân cắt tự nhiên trong đoạn đích, khuếch đại theo các phân đoạn, sau đó thực hiện phân cắt và thắt giới hạn. Nói chung, rất khó để khuếch đại trực tiếp các đoạn lớn hơn 2 kb, nhưng không phải lúc nào cũng không thể thu được: 1. Trước hết, đảm bảo tính toàn vẹn của RNA / mRNA và chiết xuất TRIZOL được ưu tiên. 2.M-MLV RT-PCR kit có thể được sử dụng trực tiếp. Kéo dài thời gian ủ và tăng số chu kỳ trong quá trình khuếch đại đúng cách. Ngoài ra, PCR lồng nhau có thể được áp dụng hoặc thực hiện một hoặc hai phản ứng trước với thời gian biến tính và kéo dài thích hợp trước khi khuếch đại PCR bình thường, có thể giúp kéo dài các đoạn. Chú ý đến độ trung thực của polymerase. 3.Long Taq có thể được sử dụng trong PCR để thu được kết quả lý tưởng. 4.Đối với ứng dụng biểu hiện protein, nên áp dụng polymerase có độ trung thực cao.
Có hai loại men sao chép ngược được TIANGEN cung cấp: Quant / King RTase và TIANScript M-MLV. Sự khác biệt chính giữa chúng là lượng mẫu đầu vào. Quant là một enzym phiên mã ngược duy nhất, khác với M-MLV thường được sử dụng có nguồn gốc từ vi rút bệnh bạch cầu Moloney murine. Quant là một loại men sao chép ngược hiệu quả cao mới được biểu hiện một cách tái tổ hợp bởi Escherichia coli kỹ thuật. Quant thích hợp để khuếch đại 50 ng-2 μg RNA có hoạt tính phiên mã ngược cao và năng suất cao. So với MMLV hoặc AMV thông thường, đặc điểm lớn nhất của Quant là nó có ái lực rất mạnh với các khuôn mẫu RNA và có thể sao chép ngược các khuôn mẫu phức tạp mà không bị biến tính ở nhiệt độ cao. Đối với các mẫu có nội dung GC cao hơn, hiệu quả ngược lại càng cao. Tuy nhiên, enzym phiên mã ngược này có hoạt tính RNase H, có thể ảnh hưởng đến độ dài của sản phẩm cDNA (thích hợp cho các khuôn mẫu <4,5 kb). Đối với phiên mã ngược thông thường, nên sử dụng men phiên mã ngược TIANScript MMLV. RTase này là một enzyme biến đổi có hoạt tính RNase H rất yếu, thích hợp cho quá trình tổng hợp cDNA dài (> 5 kb).
Phiên mã ngược một bước và khuếch đại PCR được hoàn thành trong cùng một ống mà không cần mở nắp ống giữa quá trình tổng hợp và khuếch đại cDNA, điều này rất hữu ích để giảm ô nhiễm. Vì tất cả các mẫu cDNA thu được đều được sử dụng để khuếch đại nên độ nhạy cao hơn, với tối thiểu 0,01 pg RNA tổng số. Đối với RTPCR một bước thành công, các đoạn mồi đặc hiệu của gen thường được sử dụng để bắt đầu tổng hợp cDNA. Phương pháp hai bước, cụ thể là phiên mã ngược và khuếch đại PCR được thực hiện theo hai bước. Đầu tiên, quá trình phiên mã ngược được thực hiện từ khuôn mẫu RNA để thu được cDNA, và cDNA thu được phải chịu một hoặc nhiều phản ứng PCR khác nhau. Phương pháp hai bước có thể sử dụng oligo (dT) hoặc mồi ngẫu nhiên để hướng dẫn tổng hợp chuỗi cDNA đầu tiên và có thể phiên mã ngược lại tất cả thông tin mRNA từ một mẫu cụ thể.
Danh mục sản phẩm
TẠI SAO CHỌN CHÚNG TÔI
Kể từ khi thành lập, nhà máy của chúng tôi đã phát triển các sản phẩm đẳng cấp thế giới đầu tiên với việc tuân thủ nguyên tắc
chất lượng đầu tiên. Sản phẩm của chúng tôi đã đạt được danh tiếng xuất sắc trong ngành và có giá trị trong lòng khách hàng cũ và mới ..